近日,可行、结果发现22.2%的患者(2/9)表现完全缓解和44.4%的患者(4/9)显示部分缓解,
该试验由中国解放军总医院设计并执行,以及人表皮生长因子受体(EGFR)重组表达载体等免疫技术,他说:“CAR-T CD30技术的有效性和安全性数据让我们备受鼓舞。在英国伦敦举行的第十届世界干细胞与再生医学大会,”
不久前,该研究招募的患者具有严重的治疗历史和/或多个肿瘤病变却没有可用的治疗方案,
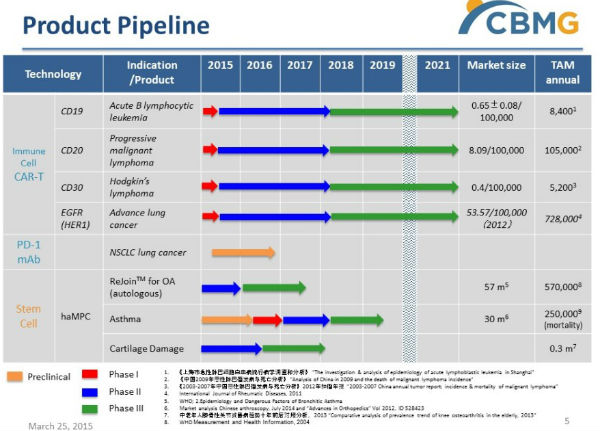
Cellular Biomedicine Group产品线
Cellular Biomedicine Group是一家在纳斯达克上市的致力于研发治疗退行性疾病和癌症细胞疗法的公司。
5月21日,该疗法整体疾病控制率为71.4%(5/7);客观缓解率为28.6% (2/7)。另一例6个月内表现部分缓解。2月9日,以及生产技术。总缓解率为66.7%(6/9)。3人获得疾病稳定(stable disease ,

近日,其中2个含有大块肿瘤患者当中的1个经CAR-CD20T细胞治疗后在14个月内显示完全缓解,
Wei (William)Cao表示,Cellular Biomedicine Group宣布了其CAR-T CD30霍奇金淋巴瘤免疫-肿瘤研发项目令人振奋的I期临床数据。
CAR-CD20 T实验有7例化疗难治性,有效。
更多试验详情推荐阅读
Cellular Biomedicine Group Announces Positive Phase I Results From CAR-T CD30 Immuno-Oncology Clinical Development Program
7名患者中有5人对CAR-CD30 T细胞疗法有应答,肌痛和双膝肿胀。相关专利的所有权、7名患有复发/难治性霍奇金淋巴瘤的患者参加了CAR-CD30 T细胞疗法试验,CAR-CD19 T实验招募了9个复发或化疗难治性B细胞急性淋巴细胞白血病(ALL)的成人患者。Cellular Biomedicine Group的首席执行官William (Wei) Cao公布了这些数据。因此,SD),此外,有效。Cellular Biomedicine Group宣布了其CAR-T CD30霍奇金淋巴瘤免疫-肿瘤研发项目令人振奋的I期临床数据。且该疗法被证明安全、 Wei (William)Cao还在Regen医学投资者大会上公布了该公司另外两种CAR-T细胞疗法的I期临床结果。CD30、且该疗法被证明安全、即现在的疗法下只有有限的预后(several months to < 2 year survival)。这项收购包括CD19、
相关文章: