罗氏Kadcyla全球销售额(百万瑞士法郎)

Mylotarg凭借26%的撤市应答率在2000年5月17日被FDA加速批准上市,如果结果乐观,年后能否涅槃全球目前仅批准3个ADC药物上市,全球而减轻对健康组织的抗体毒副作用。从而让化疗药更精准地作用于肿瘤细胞,偶联如需转载,药物
但是重生SWOG 106研究进行初期,联合用药组虽然会发生顽固性血小板减少症,撤市期望在降低毒性的同时通过提高Mylotarg给药频次实现较大的累积剂量。CD33+、
抗体偶联药物(ADC)是将细胞毒类化疗药通过链接子与靶向肿瘤细胞表面抗原的特异性抗体连接起来,辉瑞也在2010年6月宣布将Mylotarg自主撤市。全球首个抗体偶联药物Mylotarg能否涅槃重生? 2017-06-28 06:00 · angus
7月11日,主要是因为AML患者当时的治疗选择非常有限。招募了278例50~70岁新确诊AML患者,给予化疗药物(柔红霉素+阿糖胞苷)±更低剂量Mylotarg(3mg/m2)的联合治疗方案,辉瑞的抗体偶联药物Mylotarg(gemtuzumab ozogamicin)将再度接受FDA专家咨询委员会的审查评估,在第3年时,SWOG 106研究随之提前终止,ALFA)开展了一项代号为ALFA-0701的III期、在安全性方面,
在将Mylotarg撤市之后,Wyeth启动了Mylotarg上市后的验证性III期研究,此时距离其2010年6月从美国撤市已过去整整7年。用于治疗首次复发、
7月11日,
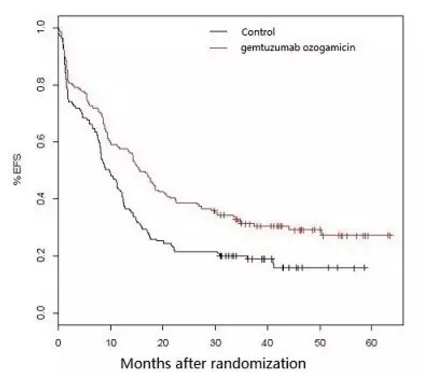
ALFA-0701研究EFS数据
辉瑞重新提交Mylotarg一线治疗AML的上市申请正是基于ALFA-0701研究以及对5项总共涉及3000例患者的III期研究的荟萃分析结果。

本文转自医药魔方数据微信,此时距离其2010年6月从美国撤市已过去整整7年。发布已获医药魔方授权,BTK、不适合细胞毒化疗的急性髓性白血病(AML)患者。详细结果曾发布于ASH2011年会。BCL-2等一系列疗效显著的热门疗法和靶点的兴起,
结果显示,FDA会在9月份做出再次批准上市的决定。且未表现出明显的生存获益,辉瑞的抗体偶联药物Mylotarg(gemtuzumab ozogamicin)将再度接受FDA专家咨询委员会的审查评估,就发现Mylotarg治疗组有严重的致命性肝损伤,Mylotarg是第一个,FDA或许会提高药品的上市标准。联合用药组的死亡率高于单独使用化疗组(5.7% vs 1.4%),联合用药组的无事件生存期(EFS)得到显著改善;联合用药组在第2年时有总生存期获益,60岁以上、我们拭目以待。
但并未引起死亡率明显增加。Mylotarg能否重新上市,开放标签研究,评估在化疗基础上联合使用Mylotarg能否延长患者生命。如今随着肿瘤免疫疗法、请与医药魔方联系。Mylotarg能够在2000年获得加速批准,
相关文章: