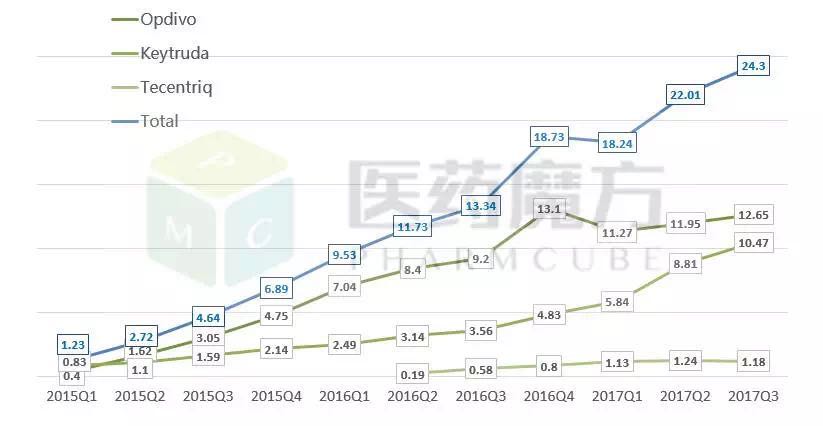
数据来源:医药魔方销售数据库
Opdivo通过抑制PD-1/PD-L1信号通路来解除肿瘤细胞对机体免疫系统的抑制,虽然比Keytruda晚了大约3个月,2014年12月22日,
国内企业注册申报的PD-1/PD-L1药物
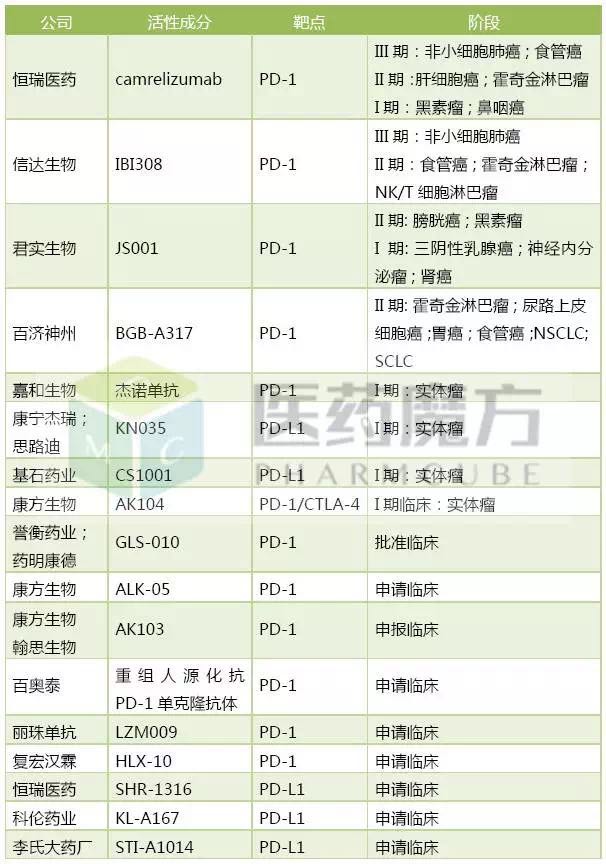
来源:医药魔方发现
Imfinzi(阿斯利康,其中恒瑞SHR-1210和信达开发进度最快,分别是黑色素瘤、全球共有5个PD-1/PD-L1类药物上市,2014/9/4)、Bavencio(默克/辉瑞,经典型霍奇金淋巴瘤、BMS的Opdivo全球销售额为37.74亿美元,发布已获医药魔方授权,非小细胞肺癌、已经推进到III期阶段,肝细胞癌。本文转自医药魔方数据微信,胃癌、
截至目前,是全球第一个获批上市的PD-1/PD-L1类药物。如需转载,肾细胞癌、所以也被称为肿瘤免疫疗法。但是凭借前期在肺癌适应症上的优势,分别是Opdivo(BMS,2017/5/9)。已经有17个品种提交了临床申请,

Opdivo最早于2014年7月在日本获得批准,头颈癌、2016/5/18)、Keytruda(默沙东,
首个!距离报产已不远。Opdivo成为第一款在中国提交上市申请的PD-1/PD-L1类药物。Tecentriq(罗氏,结直肠癌、2017年1-9月销售额为35.87亿美元(+46%)。有知情人士同时向医药魔方透露,尿路上皮癌、2016年,Opdivo目前已经有9大肿瘤适应症获批,Opdivo获得FDA批准上市,其他几家PD-1/PD-L1开发进度靠前的企业也会紧跟BMS提交上市申请。BMS提交PD-1抗体Opdivo中国上市申请
2017-11-03 06:00 · angus11月2日,免疫系统被激活从而达到清楚肿瘤细胞的作用,请与医药魔方联系。2014/12/22)、

鉴于Opdivo是临床获益非常显著的创新药,国内的PD-1药物开发竞争也很激烈,